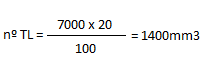FORMULA LEUCOCITARIA
MATERIALES:
Microscopio
Papel
Lápiz
Lanceta
Capilar
Portaobjetos
Pipeta pasteur
Vaso de precipitado
Cristalizador
Puente
Aceite de inmersión
Agua destilada
Panóptico rápido
REACTIVO:
Aceite de inmersión
Agua destilada
Panóptico rápido
MUESTRA:
Sangre capilar
DESARROLLO:
1. Cogemos una lanceta, gasa, alcohol y un capilar.
2. En la gasa echamos alcohol, y lo restregamos en la punta
o yema del dedo para desinfectarlo.
3. Se limpian bien los cubreobjetos con alcohol de 70º y lo
secamos.
4. La primera gota de sangre se tira, ya que puede ir
contaminada.
5. La segunda gota la depositamos en el cubreobjetos con la
ayuda del capilar.
6. Hacemos una extension sanguínea.
7. Dejamos que se seque.
8. Lo vamos metiendo en el panóptico rápido durante 5 veces, con un segundo de duración aproximadamente en el mismo componente.
9. Lo lavamos con agua destilada.
10. Lo dejamos secar verticalmente.
11. Observamos microscopicamente.
RESULTADOS:
En primer lugar, la muestra se realizo con azul de metileno, pero al no observarse nada, se realizo con la prueba de panóptico rápido.
En primer lugar, la muestra se realizo con azul de metileno, pero al no observarse nada, se realizo con la prueba de panóptico rápido.
INTERPRETACIÓN CLÍNICA:
Cayados:Desviacion a la izquierda.
Basofilos:Basofilia
Linfocitos:Linfopenia.
Segmentados:Valores normales.
Cayados:Desviacion a la izquierda.
Basofilos:Basofilia
Linfocitos:Linfopenia.
Segmentados:Valores normales.
HOJA DE TRABAJO:
1.¿Con que objetivo se observan los leucocitos cuando se determina una formula leucocitaria?
Determinar el % que tiene cada uno de los tipos de leucocitos con respecto al total de ellos. Se usa con el de 100X.
2.¿Como es el recorrido que se describe en la observacion leucocitaria?
En forma de almenas.
3.¿Cuando se han de observar al menos 200 leucocitos?
Cuando mas leucocitos mas exacta es la medicion.
4.Si de 100 leucocitos observados,20 son linfocitoss y el WBC es igual a 7000 leucocitos/mm3 de sangre, ¿Cual es el numero de linfocitos que hay en 1mm3 de sangre?
5.¿Como se llama el aumento de los monocitos?
Manocitosis.
OBSERVACIONES:
Se ven pocos reticulocitos en mi muestra.
1.¿Con que objetivo se observan los leucocitos cuando se determina una formula leucocitaria?
Determinar el % que tiene cada uno de los tipos de leucocitos con respecto al total de ellos. Se usa con el de 100X.
2.¿Como es el recorrido que se describe en la observacion leucocitaria?
En forma de almenas.
3.¿Cuando se han de observar al menos 200 leucocitos?
Cuando mas leucocitos mas exacta es la medicion.
4.Si de 100 leucocitos observados,20 son linfocitoss y el WBC es igual a 7000 leucocitos/mm3 de sangre, ¿Cual es el numero de linfocitos que hay en 1mm3 de sangre?
5.¿Como se llama el aumento de los monocitos?
Manocitosis.
OBSERVACIONES:
Se ven pocos reticulocitos en mi muestra.